來源:網絡資源 2023-08-12 19:38:47
物質的變化和性質
1、物理變化和化學變化
(1)物理變化是沒有生成其他物質的變化;
(2)物理變化宏觀上沒有新物質生成,微觀上沒有新分子生成。化學式前后一定一樣。
(3)化學變化是變化時生成了其他物質的變化。
(4)化學變化宏觀上有新物質生成,微觀上有新分子生成。化學式前后不一定不一樣(金剛石變成石墨除外)。
(5)區別:A、從宏觀上看,是否生成了其他的物質。
B、從微觀上看,發生物理變化時,只是構成物質的粒子(分子、原子、離子)之間的間隔發生了改變,粒子的本身沒有發生改變;發生化學變化時,構成物質的分子破裂,原子重新組合成新的分子,構成新的物質。
(6)聯系:在化學變化過程中,一定同時發生物理變化,而物理變化中不一定發生化學變化。
(7)判斷方法:宏觀方面是否有其他的物質生成。微觀方面是否有新分子生成。
(8)“其他物質”并不是指物質的形狀和狀態的變化,而是組成和結構的變化。
(9)在化學變化時,常伴隨有發光、發熱、變色、放出氣體、生成沉淀、爆炸等現象,這些現象只能作為判斷的輔助依據,而不能作為判斷化學變化的標準。如燈泡通電發光發熱,無色的氧氣液化變成淡藍色的液體等都是物理變化。但是沒有現象不一定是沒發生化學變化。
(10)如果只是狀態或形狀的改變,一般是物理變化。
2、物質性質
(1)物理性質包括物質的顏色、狀態、氣味、熔點、沸點、硬度、密度、溶解性、揮發性、吸附性等。
(2)物理性質也并不是只有物質發生物理變化時才表現出來的性質;例如:木材具有密度的性質,并不要求其改變形狀時才表現出來。
(3)區分物理性質和化學性質時一定要抓住是否需要發生化學變化才能表現出來。
(
利用化學性質與物理性質,不僅可以用來推斷物質及其用途,而且可以鑒別具體的物質,等等.
第二單元課題1空氣
一、空氣:
1、第一個得出空氣組成的化學家:拉瓦錫(第一個用天平進行定量分析)。
2、空氣的成分按體積分數(不是質量分數)計算:氮氣78%,氧氣21%,稀有氣體0.94%,CO20.03%,其他氣體和雜質。
3、空氣是混合物
4、空氣的污染:排放到空氣中的有害物質主要是煙塵和有害氣體(CO、SO2、氮的氧化物)。
5、空氣的污染指數越大,空氣質量級別越高,空氣質量越差。
5、空氣中有害氣體主要來自化石燃料(煤和石油等)的燃燒和工廠的廢氣、汽車排放的尾氣等。
6、二氧化碳不是污染物。
7、工業上利用分離液態空氣制取氧氣,此變化是物理變化,不是分解反應。
8、氮氣(1)化學性質不支持燃燒,不能燃燒,
(2)用途:可作保護氣,燈泡中充入可延長使用壽命,食品包裝時充氮以防腐,可作制冷劑。
9、稀有氣體(1)化學性質不活潑,(2)用途:常作保護氣,燈泡中充稀有氣體以使燈泡耐用,通電時會發出不同顏色的光,制造低溫環境。
二、空氣中氧氣含量的測定
(1)實驗原理:用紅磷燃燒消耗鐘罩內的氧氣,導致鐘罩內壓強減小,在大氣壓的作用下,水進入瓶內占據減少的氧氣所占的空間,從而測定空氣中氧氣的體積分數。
(2)反應式:4P+O22P2O5
(3)實驗步驟:
①連接裝置,并檢查裝置的氣密性。
立即
②點燃燃燒匙內的紅磷,伸入集氣瓶中,并塞子。
熄滅并冷卻
③待紅磷后,彈簧夾。
(4)實驗現象:①紅磷燃燒,產生大量白煙;②放熱;③冷卻后打開彈簧夾,水沿著導管進入集氣瓶中,進入集氣瓶內水的體積約占集氣瓶空氣總體積的五分之一。
(5)實驗結論:①O2約占1/5;②空氣是混合物;③N2約占4/5,不支持燃燒,也不能燃燒,難溶于水
(6)注意事項:
1>、可燃物要求:易燃燒,足量且產物是固體。
2>、裝置要求:氣密性良好
3>、在集氣瓶底加水的目的:吸收熱量,防止爆炸。
4>、不能否用鐵代替紅磷的原因:鐵不能在空氣中燃燒
5>、不能否用碳、硫代替紅磷的原因:因為硫、木炭燃燒生成二氧化硫、二氧化碳氣體,使壓強變化不大。
6>、不要用鎂代替紅磷的原因:鎂在空氣中燃燒時能與氮氣和二氧化碳發生反應,這樣不僅消耗氧氣,還消耗了氮氣和二氧化碳。
(7)實驗誤差
1>、液面上升小于1/5原因:
(1)裝置氣密性不好
(2)紅磷的量不足
(3)裝置未冷卻就打開彈簧夾
(4)瓶內含有殘余的氧氣
2>、液面上升大于1/5原因:
(1)在燃燒過程中未夾緊彈簧夾
(2)插入燃燒匙太慢,塞緊瓶塞之前瓶內部分空氣受熱逸出
(8)實驗改進后的優點:
裝置始終密封,實驗結論更準確,避免白煙擴散到空氣中污染環境,更環保。
三、氧氣
1、氧氣的組成:由氧元素組成的單質
2、氧氣的構成:一個氧分子由兩個氧原子構成的,或者氧氣是由氧分子構成的。
3、氧氣的物理性質:無色無味,不易溶于水,密度比空氣的略大。液氧、固態氧淡藍色。
4、氧氣的化學性質:氧氣是一種化學性質比較活潑的氣體,能跟許多物質發生化學反應,具有氧化性,能支持燃燒,有助燃性。
5、木炭
1》操作:用坩堝鉗夾取一小塊木炭,在酒精燈上加熱到發紅,由瓶口向下緩慢插入到盛有氧氣的集氣瓶中(原因是為了保證有充足的氧氣支持木炭燃燒)
2》現象:(1)發出白光,(2)生成使石灰水變渾濁的氣體
3》表達式:C+O2====CO2
6、硫
1》現象:(1)硫在空氣里燃燒發出微弱的淡藍色火焰,在氧氣里燃燒發出藍紫色火焰,(2)產生有刺激性氣味的氣體。
2》表達式:S+ O2====SO2
3》注意點:預先放入少量水或少量的氫氧化鈉溶液,吸收SO2,防止空氣污染
7、鐵絲
1》實驗操作:把光亮的細鐵絲盤成螺旋狀,下端系一根火柴,點燃火柴,待火柴快燃盡時,由上向下緩慢插入盛有氧氣的集氣瓶中(為了防止細鐵絲燃燒時放熱使氧氣從集氣瓶口逸出,保證有充足的氧氣與細鐵絲反應)。
2》現象:在氧氣中燃燒現象:(1)劇烈燃燒,火星四射,(2)生成黑色固體。
3》表達式:3Fe+2O2====Fe3O4
4》注意:
①用砂紙把細鐵絲磨成光亮的銀白色,是為了除去細鐵絲表面的雜質。
②將細鐵絲盤成螺旋狀,是為了增大細鐵絲與氧氣的接觸面積。③把細鐵絲繞在火柴上,是為了引燃細鐵絲。
④待火柴快燃盡時才緩慢插入盛有氧氣的集氣瓶中,是為了防止火柴燃燒時消耗氧氣,保證有充足的氧氣與細鐵絲反應。
⑤集氣瓶里要預先裝少量水或在瓶底鋪上一薄層細沙,是為了防止灼熱的生成物濺落使集氣瓶瓶底炸裂。
8、氧氣的利弊
1、有害的方面:食物的腐敗,鋼鐵生銹;
2、有利的方面:釀酒,釀醋,呼吸作用
9、氧氣的用途
氣焊、航天、潛水、登山、醫療、液氧炸藥、煉鐵、煉鋼
氧氣制取
一、氧氣的工業制備
1、分離液態空氣法(原理:利用N2、O2的沸點不同,N2先被蒸發,余下的是液氧(貯存在天藍色鋼瓶中)(這是物理變化,不是分解反應)
2、膜分離法
二、實驗室制氧氣
(一)、原理
MnO2
2H2O2=====2H2O+ O2↑
△
2KMnO4====K2MnO4+MnO2+ O2↑
MnO2
2KClO3======2KCl+3O2↑
△
(二)、裝置
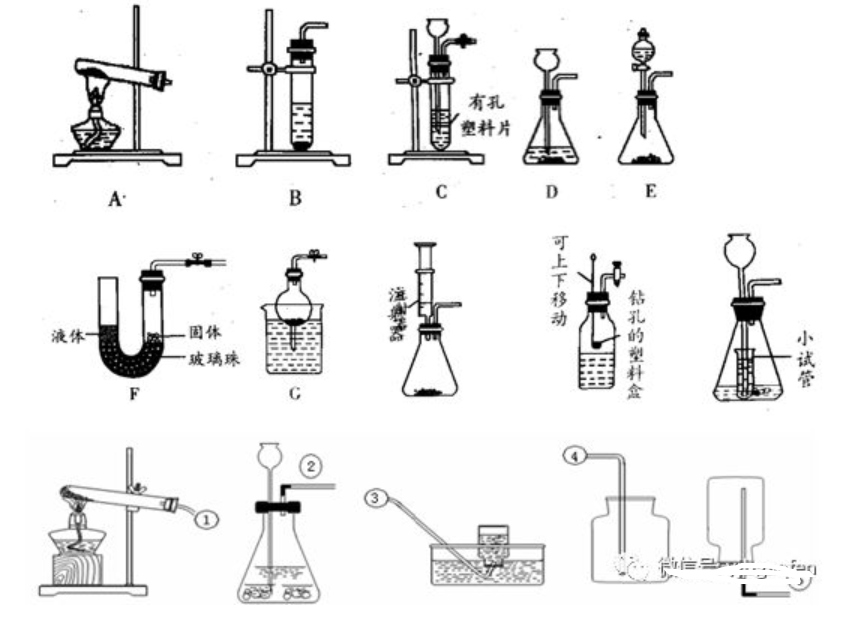
1、發生裝置:選擇的依據(或者考慮的因素)是反應物的狀態和反應條件
固體,需加熱)
(1)固固加熱型(反應物是
固體與液體,不需要加熱)
(2)固液不需加熱型(反應物是
2、收集裝置:選擇的依據(或者考慮的因素)是氣體的密度和溶解性
(1)密度比空氣大用向上排空氣法(這種收集方法收到氣體不純,但干燥)
(2)難溶或不溶于水用排水法(這種收集方法收到的氣體純凈)
3、裝置的優點:(1)便于添加液體(2)操作簡單(3)控制反應速率(或控制反應的發生或停止)
4、氣密性的檢驗:
A、把導管的一端放入盛水的燒杯中,用手緊貼容器外壁,觀察到導管口有氣泡產生,則裝置不漏氣。

B、錐形瓶與長頸漏斗
方法一:松開彈簧夾,從長頸漏斗處注水,使之下端管口浸人水中,再把導管放入裝有水的燒杯中,用兩手緊貼錐形瓶外壁,如果導管口有氣泡冒出,放開手后有少量水進人導管形成一段水柱,說明裝置不漏氣。
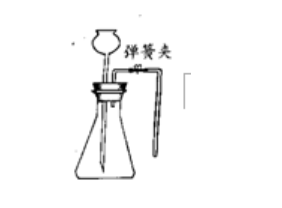
方法二:夾緊彈簀夾,從長頸漏斗處注水,使之下端管口浸入水中,繼續加水形成一段水柱,與錐形瓶內液體產生液面差,且在一段時間內水柱不發生回落,說明裝置不漏氣。
C、長頸漏斗與注射器從長頸漏斗處注水,使之下端管口浸人水中。若往外拉注射器活塞,發現長頸漏斗下端冒出氣泡,則裝置氣密性良好;若往里推活塞,發現長頸漏斗內形成段穩定的水柱,則裝置氣密性良好。

(三)、操作制取氧氣的操作步驟和注意點(以高錳酸鉀制取氧氣并用排水法收集為例)
步驟:查裝定點收移熄
1、連接儀器(從下到上,從左到右)
2、檢驗氣密性
3、裝藥品
4、固定裝置
5、點燃
6、收集氣體
7、撤離導管
8、熄滅酒精燈
(四)、驗滿:
1、如果用向上排空氣法收集,驗滿方法是用帶火星的木條放在集氣瓶口,木條復燃說明已滿。
2、如果用排水法收集,驗滿方法是看到水槽中有氣泡
(五)、檢驗:用帶火星的木條伸入集氣瓶內,木條復燃說明是氧氣。
(六)、注意事項
①試管口應略向下傾斜(防止藥品中殘存的水分受熱變成水蒸氣,遇冷倒流回試管底部,使試管炸裂。)
②藥品平鋪在試管的底部(增加物質的受熱面積。)
③鐵夾應夾在離試管口的1/4~1/3處(便于預熱)
④導管應稍露出橡皮塞(便于氣體排出)
⑤試管口應放一團棉花:防止高錳酸鉀粉末進入導管
⑦用排水法收集氧氣時,當導管口剛產生氣泡時不能立即收集,待導管口有連續均勻的氣泡冒出時再收集。因為開始時排出的氣泡里空氣,若此時收集,則氧氣不純。
⑧若用向上排空氣法收集,導管伸到集氣瓶的底部,便于空氣排出。
⑨收集滿氧氣的集氣瓶要正放,瓶口處蓋上玻璃片。
⑩實驗結束時,先移導管再熄滅酒精燈(防止水倒吸引起試管破裂)
9、以氧氣為核心的轉化關系圖

催化劑
改變
1、定義:指在化學變化里能夠化學反應的,而本身的在反應前后都沒有發生變化的物質叫做催化劑;催化劑在化學反應中的作用叫催化作用。
2、催化劑基本特征是“一變兩不變”
3、“一變”指的是改變反應速率,“改變”包括“加快”和“減慢”
4、“二不變”指的是質量和化學性質不變,(不是性質,也不是物理性質)
5、使用催化劑能使化學反應的速率不一定加快,也可能減慢
6、使用催化劑不能增加生成物的質量,而生成物的質量是由反應物的質量決定的。
7、二氧化錳不一定是用作任何反應的催化劑
8、一個反應的催化劑可以有多種。實驗室用過氧化氫制氧氣可能用二氧化錳可硫酸銅溶液作催化劑
9、催化劑不是化學反應的必要條件,它只改變化學反應的速率,而不能決定能否發生化學反應。如沒有催化劑,將過氧化氫加熱也能反應放出氧氣。
10、催化劑是參加化學反應的,但是它只是與反應物反應生成中間產物,反應結束后,又恢復為相同質量的原物質,并沒有生成其他物質,也就是說沒有生成新物質,因此催化劑只能是反應的一個條件,而不能是反應物。
11、催化劑在使用時,并不是越多越好。
12、高錳酸鉀雖能改變氯酸鉀制取氧氣的反應速率,但不是催化劑,因為它的質量和化學性質都發生了改變。
13、使用過的催化劑通過過濾、洗滌、干燥再回收利用
14、探究某種物質是不是“催化劑”時,一定要同時滿足三個條件:即(1)反應速率(2)前后質量(3)前后化學性質
反應類型
(一)化合反應
1、化合反應:把兩種或兩種以上物質生成另一種物質的反應
2、化合反應:特征是“多”變“一”。
3、表示形式:A+B+……→C。
4、化合反應屬于基本反應類型中的一種。
5、反應中各元素的化合價不一定改變。
6、反應物不一定有單質,生成物一定是化合物。
(二)分解反應
1、定義:由一種反應物生成兩種或兩種以上其他物質的反應
2、特征是“一”變“多”。
3、表示形式:A→B+C+……
4、屬于是基本反應類型中的一種,
5、反應前后,各元素化合價不一定改變。
6、反應物一定是化合物,生成物中不一定有單質。
(三)氧化反應
1、氧化反應:物質與氧之間的反應;
2、這里的“氧”不能換成“氧氣”,因為氧既包括單質氧氣,又包括化合物中的氧。
3、有氧氣參加的反應一定是氧化反應
4、氧化反應不一定有氧氣參加
5、氧化反應不屬于基本反應類型。
編輯推薦:

歡迎使用手機、平板等移動設備訪問中考網,2025中考一路陪伴同行!>>點擊查看